Aula de Henrique de Cristo.
Ligações Químicas
Átomos quase nunca aparecem sozinhos na natureza. Normalmente, eles vêm em grupos, de modo que seus elétrons ocupem estados menos energéticos do que se estivessem separados. Essa atração estável entre átomos é chamada de ligação química. A rigor, essas ligações são explicadas pela teoria quântica. Mas, na prática, as pessoas que fazem química lançam mão de algumas aproximações que nos dispensam de um trabalho mais rigoroso em física avançada.
No início do século XX, a comunidade científica descobriu que a física, quando olhada de perto, era fundamentalmente diferente do que Newton pensara. Vários experimentos — envolvendo radiação de corpo negro, efeito fotoelétrico e espectros atômicos — mostraram que as predições da física clássica não batiam com as medições de fato. Assim, começou o desenvolvimento de um novo modelo para explicar a escala microscópica das coisas: a teoria quântica.
Max Planck, ao ver que a radiação emitida por um corpo negro discordava da equação de Rayleigh-Jeans para comprimentos de onda pequenos, tentou remendar o modelo com uma gambiarra. Ele postulou que um oscilador de frequência natural  só poderia emitir ou absorver energia em parcelas da quantidade de energia
só poderia emitir ou absorver energia em parcelas da quantidade de energia  , sendo
, sendo  uma nova constante fundamental da natureza. Ou seja, em vez de considerar o fluxo de energia da luz algo contínuo (como parece ser a correnteza de um rio), ele postulou que ele seria composto por "pacotinhos" de energia
uma nova constante fundamental da natureza. Ou seja, em vez de considerar o fluxo de energia da luz algo contínuo (como parece ser a correnteza de um rio), ele postulou que ele seria composto por "pacotinhos" de energia  (granular como uma corrente de areia). Cada um desses pacotes seria um quantum (uma unidade fundamental; plural: quanta).
(granular como uma corrente de areia). Cada um desses pacotes seria um quantum (uma unidade fundamental; plural: quanta).
Albert Einstein adaptou essa ideia para explicar a maneira como elétrons eram ejetados de placas metálicas quando luz incidia sobre elas. Com isso, Rutherford e Bohr chegaram a um modelo do átomo de hidrogênio que era coerente com as evidências. Mais adiante, Werner Heisenberg propôs o princípio da incerteza: quanto mais precisamente se conhece a posição de uma partícula, menos precisamente se conhece sua velocidade. Sendo  a incerteza sobre a posição e
a incerteza sobre a posição e  a incerteza sobre o momentum,
a incerteza sobre o momentum,

Assim, é impossível saber, com absoluta certeza, onde está um elétron e quão rápido ele se move. Isso não é uma limitação experimental ou algo do tipo; é uma característica intrínseca à natureza (ou, pelo menos, todos os experimentos até hoje indicam que seja).
Para nós, o que interessa agora é que um elétron não tem posição, no sentido clássico da palavra. Isso mesmo. Em vez disso, como qualquer sistema quântico, o conjunto de elétrons de um átomo tem sua dinâmica descrita por um objeto matemático chamado de função de onda, denotada por  . Grosso modo, a função de onda está associada às possíveis configurações do sistema. Além disso, o quadrado da função de onda
. Grosso modo, a função de onda está associada às possíveis configurações do sistema. Além disso, o quadrado da função de onda  representa a probabilidade de medir a presença de um elétron num dado volume do espaço.
representa a probabilidade de medir a presença de um elétron num dado volume do espaço.
Por outro lado, existem regiões do espaço onde a probabilidade de encontrar um elétron é especialmente alta: os orbitais. Se medirmos a posição de um elétron repetidas vezes e plotarmos cada medida como um ponto, então obeteremos um gráfico de nuvem eletrônica:

Com um número estatisticamente significativo dessas medições, a nuvem eletrônica serve como boa aproximação da ideia de orbital (quanto mais pontos acumulados, maior a densidade de probabilidade nessa região).
Cada orbital é definido por três valores chamados de números quânticos: o principal  , o azimutal
, o azimutal  e o magnético
e o magnético  . Respectivamente, eles descrevem três propriedades do elétron que ocupa tal orbital: sua energia, seu momentum angular e a componente de seu momentum angular numa dada direção. Pelo princípio da exclusão de Pauli, dois elétrons nunca podem ter o mesmo estado quântico ao mesmo tempo. Assim, se dois elétrons têm valores iguais para
. Respectivamente, eles descrevem três propriedades do elétron que ocupa tal orbital: sua energia, seu momentum angular e a componente de seu momentum angular numa dada direção. Pelo princípio da exclusão de Pauli, dois elétrons nunca podem ter o mesmo estado quântico ao mesmo tempo. Assim, se dois elétrons têm valores iguais para  ,
,  e
e  , eles obrigatoriamente têm valores diferentes para o quarto número quântico: o spin
, eles obrigatoriamente têm valores diferentes para o quarto número quântico: o spin  . Assim, um orbital pode conter, no máximo, dois elétrons.
. Assim, um orbital pode conter, no máximo, dois elétrons.
Como se explicou em outra aula, os elétrons ocupam os orbitais em ordem crescente de energia (que pode ser consultada em um diagrama de diagonais). Por exemplo, o hidrogênio tem configuração eletrônica  . Mas acontece que, por motivos que ultrapassam o escopo desta aula, a configuração
. Mas acontece que, por motivos que ultrapassam o escopo desta aula, a configuração  , com o orbital 1s completamente preenchido, é mais estável. Por isso um átomo de hidrogênio tende a se ligar a outro, formando a molécula
, com o orbital 1s completamente preenchido, é mais estável. Por isso um átomo de hidrogênio tende a se ligar a outro, formando a molécula  . Da mesma forma, a maioria dos átomos rearranja seus elétrons para atingir estados menos energéticos. As principais exceções a essa regra são os átomos do décimo oitavo grupo da tabela periódica, que são estáveis por si sós e recebem o nome especial de gases nobres.
. Da mesma forma, a maioria dos átomos rearranja seus elétrons para atingir estados menos energéticos. As principais exceções a essa regra são os átomos do décimo oitavo grupo da tabela periódica, que são estáveis por si sós e recebem o nome especial de gases nobres.
Em geral, os experimentos mostram que: se um átomo isolado tem um subnível  ou
ou  como o mais energético, então ele tenderá a fazer ligações químicas de modo a preencher ou esvaziar completamente esse subnível.
como o mais energético, então ele tenderá a fazer ligações químicas de modo a preencher ou esvaziar completamente esse subnível.
Essa regra é conhecida como regra do octeto. O nome vem do fato de, excetos hidrogênio e hélio, os átomos desses grupos atingirem estabilidade quando têm  elétrons na camada mais externa, assemelhando-se aos gases nobres.
elétrons na camada mais externa, assemelhando-se aos gases nobres.
A hipótese dessa sentença significa que tal regra só vale para os blocos  e
e  a seguir:
a seguir:
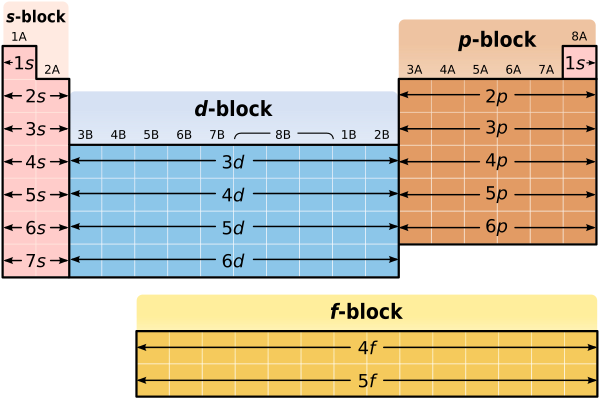
Ligações iônicas
Imagine a situação do átomo de cloro. Sozinho, a configuração de seus elétrons é  , logo seu orbital mais energético é do tipo
, logo seu orbital mais energético é do tipo  . Pela regra que estabelecemos, ele tende a receber 1 elétron (ou perder 7). Analogamente, um átomo de sódio (
. Pela regra que estabelecemos, ele tende a receber 1 elétron (ou perder 7). Analogamente, um átomo de sódio ( ) tende a perder 1 elétron (ou ganhar 7). Custa menos energia mexer menos elétrons, então entre as duas opções, é mais comum que a que envolva menos elétrons aconteça.
) tende a perder 1 elétron (ou ganhar 7). Custa menos energia mexer menos elétrons, então entre as duas opções, é mais comum que a que envolva menos elétrons aconteça.
Como você pode suspeitar, é por isso que o sal de cozinha é mais abundante que átomos  ou
ou  isolados. Se ambos buscam satisfazer o octeto, basta que o sódio doe um elétron ao cloro. A esse tipo de ligação química, em que um átomo cede elétrons e outro os recebe, chamamos iônica.
isolados. Se ambos buscam satisfazer o octeto, basta que o sódio doe um elétron ao cloro. A esse tipo de ligação química, em que um átomo cede elétrons e outro os recebe, chamamos iônica.
O átomo que cede elétrons é chamado de cátion, e o que recebe é chamado de ânion.
Normalmente, ligações iônicas ocorrem entre um metal e um não metal, pois há grande diferença de eletronegatividade entre eles. Compostos iônicos são sólidos às CNTP, possuem altas temperaturas de fusão e ebulição, solubilizam-se em solventes polares (como a água), apresentam estruturas cristalinas e conduzem corrente elétrica.
Proporção de íons em ligação
Existe um dispositivo prático para determinar a fórmula do composto iônico resultante de ligação iônica, dadas as cargas do cátion e do ânion. A regra prescreve que o módulo de cada uma dessas cargas corresponde, respectivamente, ao índice do ânion e do cátion na fórmula final. Em casos mais complicados, pode ser necessário simplificar os índices até que a razão entre eles seja irredutível.
Por exemplo,  e
e  podem se ligar ionicamente, formando
podem se ligar ionicamente, formando  : há um elétron de valência "faltando" no lítio e dois "sobrando" no oxigênio, de maneira que precisaremos de dois átomos de lítio e um átomo de oxigênio. Tente justificar o fato de esse dispositivo prático funcionar, levando em conta a natureza de ligações iônicas.
: há um elétron de valência "faltando" no lítio e dois "sobrando" no oxigênio, de maneira que precisaremos de dois átomos de lítio e um átomo de oxigênio. Tente justificar o fato de esse dispositivo prático funcionar, levando em conta a natureza de ligações iônicas.
Para que um composto iônico seja eletricamente neutro, o número de elétrons de valência "faltando" nos cátions deve ser igual ao número de elétrons "sobrando" nos ânions. Sejam  cátions
cátions  e
e  ânions
ânions  que formam um composto iônico. Então o módulo da carga total sobrando deve ser igual ao módulo da carga total faltando:
que formam um composto iônico. Então o módulo da carga total sobrando deve ser igual ao módulo da carga total faltando:  , isto é,
, isto é,  , o que justifica o dispositivo. Como, por definição, a fórmula de um composto iônico deve representar a proporção mínima entre os íons,
, o que justifica o dispositivo. Como, por definição, a fórmula de um composto iônico deve representar a proporção mínima entre os íons,  e
e  devem ser primos entre si, o que justifica a simplificação de índices.
devem ser primos entre si, o que justifica a simplificação de índices.
Ligações covalentes
Se a diferença de eletronegatividade entre dois não metais for pequena, eles podem atingir o octeto compartilhando pares de elétrons e formando uma molécula. Nesse caso, é como se os elétrons, que antes ocupavam um só orbital de um átomo, passassem a ocupar um orbital híbrido entre os dois átomos.
Normalmente, moléculas aparecem em variados estados de agregação às CNTP, possuem baixas temperaturas de fusão e ebulição e não conduzem corrente elétrica quando puros (em água, algumas conduzem, como  ).
).
Note que o par de elétrons a ser compartilhado pode ser formado por um elétron de cada átomo ou por dois elétrons de um átomo só. Nesse último caso, a ligação covalente é dita coordenada.
Ligações metálicas
Os metais de transição não seguem a regra do octeto. Em vez disso, um modelo que explica bem seu comportamento é o do mar de elétrons. Quando esses metais se ligam, seus elétrons deslocalizam-se, formando uma espécie de "mar" de elétrons e cátions "soltos".
Normalmente, compostos metálicos são sólidos às CNTP (menos o mercúrio), possuem altas temperaturas de fusão e ebulição, conduzem corretes elétricas (porque há elétrons livres) e apresentam brilho característico e retículo cristalino.
Referências bibliográficas e textos complementares
- DRENNAN, C. Principles of Chemical Science. Massachusetts Institute of Technology: MIT OpenCouseWare, https://ocw.mit.edu/. License: Creative Commons BY-NC-SA.
- ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2012.
- BROWN, T. et al. Química: a ciência central. 13 ed. São Paulo: Pearson Education do Brasil, 2016.
- FELTRE, R. Química, volume 1, 6 ed. São Paulo: Moderna, 2004
- CANTO, Eduardo Leite do; PERUZZO Francisco Miragaia. Química na abordagem do cotidiano. 4a ed. São Paulo, 2006. Vol 1.
As figuras sobre notação de Lewis foram retiradas do OpenStax Chemistry. As figuras sobre geometria molecular foram retiradas da primeira referência (MIT OCW).


